Metastasis
มะเร็งแพร่กระจาย (Metastasis) คือการแพร่กระจายของเซลล์เนื้องอกจากตำแหน่งเริ่มต้นไปยังอวัยวะรอบข้างอวัยวะอื่นๆที่ห่างไกล(distant metastasis) ถือเป็นสาเหตุสำคัญของความเจ็บป่วยและการเสียชีวิตของคนไข้มะเร็ง การแพร่กระจายไปยังอวัยวะอื่นๆที่ห่างไกลเป็นตัวบ่งชี้ถึงความรุนแรงของเนื้องอกชนิดต่างๆของอวัยวะต้นกำเนิดมะเร็ง (primary site) การแพร่กระจายสู่ปอดเป็นกระบวนการหลายขั้นตอนที่ซับซ้อน เซลล์เนื้องอกที่แพร่กระจายจะต้องผ่านขั้นตอนต่าง ๆ เช่น การหลุดออกจากเนื้องอกตำแหน่งเริ่มต้น การบุกรุกเข้าไปในหลอดเลือด (เช่น เส้นเลือดฝอย เส้นเลือดน้ำเหลือง) การแทรกซึมเข้าสู่ตำแหน่งที่เหมาะสม และการสร้างสภาพแวดล้อมขนาดเล็กที่เหมาะแก่การเติบโตของเนื้องอกนั้น มะเร็งที่พบบ่อยที่แพร่กระจายเข้าสู่เนื้อเยื่อปอด ได้แก่ มะเร็งเต้านม มะเร็งปอด มะเร็งลำไส้ใหญ่ มะเร็งกล้ามเนื้อมดลูก (uterine leiomyosarcoma) มะเร็งเซลล์แบนบริเวณศีรษะ/ลำคอ มะเร็งกระดูก (osteosarcoma) เป็นต้น เซลล์มะเร็งสามารถแพร่กระจายจากเซลล์ต้นกำเนิดได้ตามช่องทางต่างๆ ดังนี้
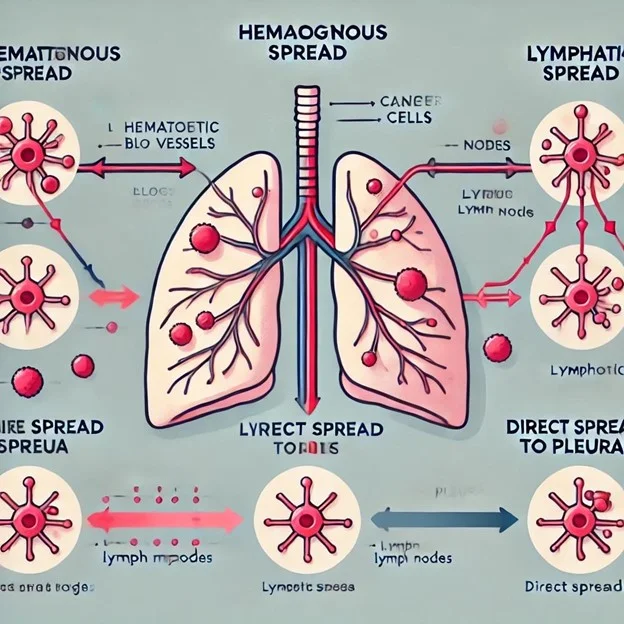
- การแพร่กระจายทางเลือด (Hematogenous spread): พบในเนื้องอกที่มีการระบายเลือดผ่านทางหลอดเลือดดำเข้าสู่ปอด เช่น มะเร็งศีรษะและลำคอ มะเร็งต่อมไทรอยด์ มะเร็งต่อมหมวกไต มะเร็งไต มะเร็งอัณฑะ มะเร็งเมลาโนมา และมะเร็งกระดูก (osteosarcoma)
- การแพร่กระจายทางระบบน้ำเหลือง (Lymphatic spread): เกิดขึ้นได้ 2 วิธีคือ การลุกลามแบบไปข้างหน้า (antegrade) ผ่านทางกะบังลมหรือพื้นผิวเยื่อหุ้มปอด หรือการแพร่กระจายแบบย้อนกลับ (retrograde) จากการแพร่กระจายของต่อมน้ำเหลืองที่บริเวณ hilum ตัวอย่างได้แก่ มะเร็งปอด มะเร็งกระเพาะอาหาร มะเร็งเต้านม มะเร็งตับอ่อน มะเร็งมดลูก มะเร็งทวารหนัก และมะเร็งต่อมลูกหมาก
- การแพร่กระจายโดยตรงสู่เยื่อหุ้มปอด (Direct spread to pleura): เกิดจากการแพร่กระจายทางเลือดไปยังเยื่อหุ้มปอด โดยมีการแพร่กระจายทางระบบน้ำเหลือง หรือจากการแพร่กระจายจากเนื้องอกในตับ ตัวอย่างได้แก่ มะเร็งปอด มะเร็งเต้านม มะเร็งตับอ่อน และมะเร็งกระเพาะอาหาร
ปอดเป็นตำแหน่งที่มีการแพร่กระจายของเนื้องอกบ่อยเป็นอันดับสอง มีการประมาณว่า 20% ถึง 54% ของเนื้องอกมะเร็งที่พัฒนาในส่วนอื่นของร่างกายจะมีการแพร่กระจายสู่ปอด ผู้ป่วยที่มีการแพร่กระจายไปยังปอดจะมีพยากรณ์โรคและทางเลือกในการรักษาที่แตกต่างจากเนื้องอกเริ่มต้น การแพร่กระจายไปยังตำแหน่งที่ห่างไกลมีบทบาทสำคัญในการจัดระยะของเนื้องอก ตัวอย่างเช่น การแพร่กระจายของมะเร็งเต้านมลดอัตราการรอดชีวิต 5 ปีจาก 96% เหลือ 21% ในมะเร็งลำไส้ใหญ่ ผู้ป่วยที่มีการแพร่กระจายไปยังปอดหรือตับจะมีอัตราการรอดชีวิต 5 ปีน้อยกว่า 10% เมื่อเทียบกับ 91% ในผู้ที่ไม่มีการแพร่กระจายไปยังตำแหน่งที่ห่างไกล การพบรอยโรคมะเร็งจากการตรวจชิ้นเนื้อ มีอัตราสูงกว่ามากในกรณีที่มีก้อนหลายก้อนในปอด การศึกษาสรุปว่าก้อนเนื้อในปอดหลายก้อน (> 5 มม.) และการมีโพรงในก้อนเนื้อมีความสัมพันธ์กับโอกาสสูงที่สุดที่จะเป็นโรคมะเร็งที่แพร่กระจาย อย่างไรก็ตาม เมื่อพบก้อนในปอดหลายๆ ก้อนยังไม่ควรสรุปว่าเป็นการแพร่กระจายของมะเร็งโดยไม่ทำ biopsy ก่อน
Table of Contents
ประวัติและการตรวจร่างกาย
ผู้ป่วยที่มีการแพร่กระจายไปยังปอดอาจมีเนื้องอกเริ่มต้นที่ทราบอยู่แล้วหรือแสดงอาการเป็นครั้งแรกด้วยการแพร่กระจายไปยังปอด ผู้ป่วยอาจมีอาการหรือไม่มีอาการก็ได้ การแพร่กระจายไปยังปอดอาจแสดงในรูปแบบของการแพร่กระจายเพียงก้อนเดียวหรือหลายก้อน
อาการ
ผู้ป่วยอาจไม่มีอาการและมักพบว่ามีก้อนเนื้อในปอดจากการติดตามการรักษามะเร็งเริ่มต้น แต่ในบางราย อาจมีอาการได้โดย อาการทั่วๆไป ได้แก่ เหนื่อยล้า, คลื่นไส้, เบื่ออาหาร, น้ำหนักลด หรืออาการเฉพาะที่ได้แก่. เยื่อหุ้มปอดอักเสบ/มีน้ำในเยื่อหุ้มปอด ไอ (ทั้งแบบมีเสมหะและไม่มีเสมหะ) หายใจลำบาก ไอเป็นเลือด เป็นต้น
การตรวจร่างกาย
การตรวจปอด: ปกติหรืออาจพบเสียงหวีดที่เกิดจากการหายใจออกถ้ามีก้อนเนื้องอกที่เกี่ยวกับหลอดลม, เสียงกรอบแกรบถ้าถุงลมมีของเหลวหรือปอดอักเสบหลังจากการอุดตัน, หรือเสียงหายใจลดลงถ้ามีน้ำในเยื่อหุ้มปอดหรือปอดแฟบ อาการอื่นๆที่ตรวจพบได้เช่น นิ้วมือปุ้ม (Digital clubbing) น้ำหนักลด ต่อมน้ำเหลืองโต แขนบวม หรืออ่อนแรงจากเนื้องอกไปกด (Pancoast and Superior vena cava syndrome ) เป็นต้น
การตรวจวินิจฉัย
การถ่ายภาพรังสีทรวงอกเป็นการตรวจเริ่มต้นที่มักทำในผู้ป่วยที่มีอาการและผู้ป่วยที่ทราบว่าเป็นเนื้องอกเริ่มต้น เนื่องจากมีค่าใช้จ่ายต่ำและทำได้ง่าย ข้อเสียคือการแพร่กระจายขนาดเล็กหรือแบบกระจายละเอียดไม่สามารถมองเห็นได้ การตรวจเอกซเรย์คอมพิวเตอร์ (CT) ของทรวงอกเป็นทางเลือกถัดไป โดยมีการใช้ภาพฉายแบบหลายแผนหรือการฉายภาพความเข้มสูงสุดเพื่อเพิ่มความไว CT แบบเกลียวมีความไวมากกว่าเนื่องจากอัตราการตรวจพบการแพร่กระจายสูงกว่าเทคนิคการถ่ายภาพอื่นๆ ก้อนเนื้อขนาดเล็กถึง 3 มม. สามารถตรวจพบได้ในแผ่นภาพขนาด 5 ถึง 10 มม.
การตรวจด้วยเอกซเรย์ปล่อยโพซิตรอน (PET) โดยใช้อนุพันธ์ของน้ำตาล(FDG) ใช้เพื่อตรวจหาการแพร่กระจายไปยังส่วนอื่นของร่างกาย PET-CT ถูกใช้เพื่อระบุตำแหน่งที่แม่นยำของการแพร่กระจายที่ซ้อนทับอยู่บนภาพ CT การส่องกล้องหลอดลมพร้อมอัลตราซาวนด์หลอดลม (EBUS) เป็นส่วนมาตรฐานของการวินิจฉัยก่อนการผ่าตัด ช่วยให้สามารถประเมินเยื่อเมือกและยืนยันลักษณะทางเนื้อเยื่อวิทยาของการแพร่กระจายที่อยู่ตรงกลาง เมื่อรวมกับอัลตราซาวนด์หลอดลมจะช่วยระบุสถานะของต่อมน้ำเหลืองรอบหลอดลมและเยื่อกลางทรวงอก การตัดชิ้นเนื้อโดยใช้ CT นำทางเป็นแนวทางสำหรับรอยโรคที่อยู่บริเวณรอบนอกหรือรอยโรคที่อยู่ใกล้หลอดเลือดขนาดใหญ่
เคมีบำบัด
เคมีบำบัดมักจะไม่สามารถรักษาการแพร่กระจายไปยังปอดให้หายขาดได้ ยกเว้นเนื้องอกบางชนิด ตัวอย่างเช่น การบำบัดด้วยซิสพลาตินเป็นยาหลักสำหรับมะเร็งเซลล์สืบพันธุ์ในอัณฑะ ซึ่งให้ผลในการรักษาระยะยาวที่สูงมาก เคมีบำบัดมีบทบาทสำคัญในการรักษามะเร็งกระดูก การให้ยาเคมีบำบัดล่วงหน้าก่อนการผ่าตัด (neoadjuvant) สามารถลดขนาดของเนื้องอกและช่วยควบคุมการแพร่กระจายของโรคได้ ประมาณหนึ่งในสามของก้อนเนื้อในปอดทั้งหมดหายไปหลังจากได้รับเคมีบำบัดก่อนการผ่าตัด ผู้ป่วยยังควรได้รับการรักษาด้วยเคมีบำบัดเสริมหลังการผ่าตัด (postoperative adjuvant chemotherapy) อัตราการรอดชีวิตโดยปราศจากโรคเป็นเวลา 2 ปีหลังการเคมีบำบัดและการผ่าตัดอยู่ที่ 56% มีการศึกษาในผู้ป่วยที่ได้รับการรักษาด้วยเคมีบำบัดและการผ่าตัดในมะเร็งกระดูกที่มีการแพร่กระจายไปยังปอดเมื่อเทียบกับการรักษาด้วยเคมีบำบัดเพียงอย่างเดียว ผู้ป่วยที่มีการแพร่กระจายน้อยกว่า 8 แห่งที่จำกัดเฉพาะในปอดมีอัตราการรอดชีวิตโดยปราศจากโรคเป็นเวลา 5 ปีที่ 66.7% การผ่าตัดเอาจุดที่แพร่กระจายออกทั้งหมดจึงเป็นสิ่งสำคัญ ในกรณีที่มีการกลับมาเป็นซ้ำ การผ่าตัดทรวงอกซ้ำและการเลาะเนื้องอกที่สามารถผ่าตัดได้ก็ได้ผลการรักษาที่ดี การใช้รังสีบำบัดอาจเป็นทางเลือกในผู้ป่วยที่ไม่มีสามารถทนการผ่าตัดได้
การผ่าตัดเนื้องอกที่แพร่กระจายออก(metastasectomy)
เกณฑ์ในการคัดเลือกผู้ป่วยที่เหมาะสมสำหรับการผ่าตัดเลาะเนื้องอกที่แพร่กระจายไปยังปอด:
- การสามารถผ่าตัดออกได้
- ทนการผ่าตัดได้ มีความเสี่ยงจากการผ่าตัดน้อย
- เนื้องอกเริ่มต้นสามารถควบคุมได้
- ไม่มีการแพร่กระจายไปอวัยวะอื่นๆนอกทรวงอก
ผลการรักษาที่ดีหลังการรักษาด้วยการผ่าตัดเนื้องอกที่แพร่กระจายไปยังปอดขึ้นอยู่กับปัจจัยต่อไปนี้:
- ช่วงเวลาที่ปราศจากโรคเป็นเวลานานระหว่างการรักษาเนื้องอกเริ่มต้นและการค้นพบเนื้องอกที่แพร่กระจายไปยังปอด
- ไม่มีการแพร่กระจายของต่อมน้ำเหลืองทรวงอก
- จำนวนเนื้องอกที่แพร่กระจายไปยังปอดมีจำนวนน้อย
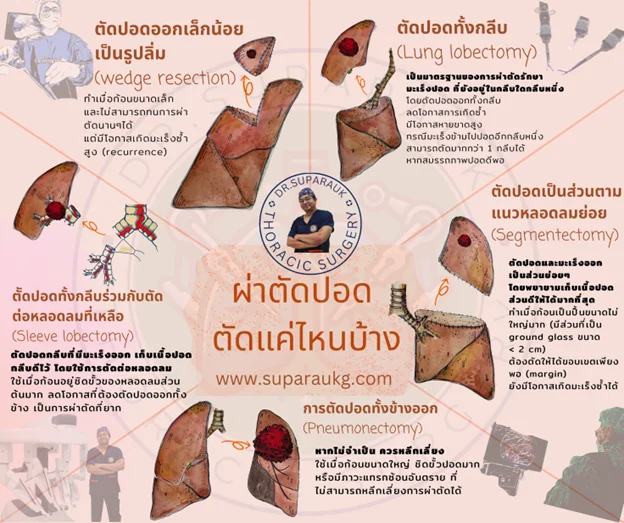
ขั้นตอนมาตรฐานคือการตัดเนื้องอกในปอดออกโดยเก็บเนื้อปอดส่วนดีไว้ให้มากที่สุด และขอบเขตของเนื้อปอดที่ผ่าตัดออกไปห่างพอจากก้อนเนื้องอก (wedge resection) ดังนั้นหากมีปริมาณเนื้องอกมาที่ปอดไม่เยอะเกินไป (โดยทั่วไป 5-10 ก้อน) สามารถผ่าตัดได้ โดยไม่ส่งผลกระทบต่อการหายใจหลังผ่าตัดมากนัก บางครั้งอาจจำเป็นต้องทำการผ่าตัดแบบตามกายวิภาค เช่น การตัดปอดออกตามส่วนย่อยของหลอดลมในเนื้อปอด (segmentectomy)หากก้อนอยู่กระจุกตัวกันในส่วนใดส่วนหนึ่งของปอด หรือบางครั้งก้อนใหญ่ อยู่กลางปอด หรือหลายๆก้อนในปอดกลีบเดียวกัน ก็สามารถตัดปอดทั้งกลีบ (lobectomy) ได้ หากสมรรถภาพของปอดดีพอ แต่ไม่แนะนำให้ตัดปอดออกทั้งข้าง (pneumonectomy) เพราะจะเกิดผลเสียมากกว่าประโยชน์ที่ได้รับ ยกเว้นกรณีที่เลี่ยงไม่ได้เช่นเกิดภาวะแทรกซ้อนหนัก เป้นต้น

วิธีการผ่าตัด ในมือผู้เชี่ยวชาญ สามารถผ่าตัดผ่านกล้องได้เหมือนการรักษามะเร็งปอด ( VATS -Video-assisted thoracoscopic surgery) กรณีก้อนเนื้องอกขนาดเล็กที่ตรวจพบระหว่างผ่าตัดได้ยาก ก็สามารถใช้วิธีระบุตำแหน่งก้อนเนื้องอกก่อนผ่าตัดได้ โดยใช้สาร Marker ช่วยผ่านการนำทางโดยใช้ CT หรือการส่องกล้องหลอดลมก็สามารถทำได้
อัตราการรอดชีวิต 5 ปีหลังจากการผ่าตัดเลาะเนื้องอกที่แพร่กระจายไปยังปอด ขึ้นอยู่กับเนื้องอกเริ่มต้น ได้แก่
- มะเร็งเซลล์ไต อัตราการรอดชีวิต 5 ปี อยู่ที่ 35.5% ถึง 47%, แต่หากไม่ได้รับการผ่าตัดปอด อัตราการรอดชีวิตเฉลี่ยอยู่ที่ 8 ถึง 12 เดือน และอัตราการรอดชีวิต 5 ปีอยู่ที่เพียง 2% ถึง 3%
- มะเร็งลำไส้ใหญ่ อัตราการรอดชีวิต 5 ปี อยู่ที่ 39.1% ถึง 67.8%, แต่หากไม่ได้รับการผ่าตัดปอด อัตราการรอดชีวิตเฉลี่ยอยู่ที่ 8 เดือน และอัตราการรอดชีวิต 1 ปีอยู่ที่ 30%
- มะเร็งเต้านม: ผู้ป่วยที่ได้รับการผ่าตัดเลาะเนื้องอกที่แพร่กระจายไปยังปอดมีอัตราการรอดชีวิตเฉลี่ยอยู่ที่ 35 ถึง 75.6 เดือน โดยมีอัตราการรอดชีวิต 5 ปีอยู่ที่ 38% ถึง 54% แต่หากไม่ได้รับการรักษา อัตราการรอดชีวิตเฉลี่ยของผู้ป่วยที่มีการแพร่กระจายไปยังปอดอยู่ที่ 21 เดือน ในขณะที่ผู้ป่วยที่มีการแพร่กระจายจำกัดเฉพาะที่ปอดมีอัตราการรอดชีวิตเฉลี่ยอยู่ที่ 25 เดือน
- มะเร็งเนื้อเยื่ออ่อน อัตราการรอดชีวิต 5 ปี อยู่ที่ 29% ถึง 52%,
- มะเร็งกระดูก อัตราการรอดชีวิต 5 ปี อยู่ที่ 38% ถึง 49.7%,
- มะเร็งเซลล์สืบพันธุ์ที่ไม่ใช่ seminomatous อัตราการรอดชีวิต 5 ปี อยู่ที่ 79% ถึง 94%
- ซอฟต์ทิชชูซาร์โคมา (Soft Tissue Sarcoma): มักจะถูกค้นพบว่าเป็นการแพร่กระจายที่เกิดขึ้นภายหลังในระหว่างการเกิดโรค เนื่องจากการแพร่กระจายมีความไวต่อเคมีบำบัดในระดับปานกลาง จึงควรรักษาด้วยการผ่าตัด รายงานการรอดชีวิต 5 ปีหลังการผ่าตัดอยู่ระหว่าง 29% ถึง 52%
- มะเร็งกระดูก (Osteosarcoma): แม้ว่าจะได้รับการรักษาด้วยเคมีบำบัด การผ่าตัด และรังสีบำบัด แต่การรอดชีวิต 5 ปีของผู้ป่วยเหล่านี้อยู่ระหว่าง 40% ถึง 20% มะเร็งกระดูกที่มีการแพร่กระจายเริ่มต้นมีพยากรณ์ที่ไม่ดี เมื่อค้นพบในขณะการรักษาเป้าหมายของการผ่าตัดคือการเอาเนื้องอกที่แพร่กระจายออกทั้งหมดหลังจากเคมีบำบัดและการผ่าตัดเอาเนื้องอกเริ่มต้นออก ในกรณีที่มีการแพร่กระจายไปยังปอดซ้ำ การผ่าตัดซ้ำเป็นสิ่งจำเป็น
- มะเร็งกระดูกอ่อน (Chondrosarcoma): การผ่าตัดเลาะเนื้องอกที่แพร่กระจายและการทำ Radiofrequency Ablation (RFA) ส่งผลต่อพยากรณ์โรคในผู้ป่วยที่มี Chondrosarcoma ที่แขนขาและมีการแพร่กระจายไปยังปอด การแพร่กระจายนอกปอดและความรุนแรงของเนื้องอกที่ไม่ดีส่งผลต่อพยากรณ์โรค การรอดชีวิต 3 ปีและ 5 ปีหลังการแพร่กระจายไปยังปอดคือ 51.5% และ 45.7% ตามลำดับ ควรพิจารณาทางเลือกในการผ่าตัด
- มะเร็งเมลาโนมา: อัตราการรอดชีวิตเฉลี่ยของมะเร็งเมลาโนมาที่แพร่กระจายอยู่ที่เพียง 6 ถึง 8 เดือน และอัตราการรอดชีวิต 5 ปีอยู่ที่ประมาณ 5% อวัยวะที่พบการแพร่กระจายมากที่สุดคือปอดใน 40% ของกรณี การผ่าตัดเอาออกทั้งหมดมีประโยชน์และสัมพันธ์กับอัตราการรอดชีวิต 5 ปีสูงถึง 39% เมื่อเทียบกับอัตราการรอดชีวิต 5 ปีที่ 3% ถึง 5% สำหรับผู้ป่วยที่ได้รับการรักษาทางระบบ
- มะเร็งเซลล์สืบพันธุ์ที่ไม่ใช่เซลล์ seminoma (Non-seminomatous germ cell tumors): อัตราการรอดชีวิตเฉลี่ยโดยรวมหลังการผ่าตัดเอาเนื้องอกออกหลังเคมีบำบัดอยู่ที่ 23.4 ปี
ผู้ป่วยที่มีการผ่าตัดออกได้ทั้งหมด (R0 resection) ของรอยโรคเพียงจุดเดียวและมีช่วงเวลาปลอดโรคมากกว่า 3 ปีหลังการผ่าตัดรักษาเนื้องอกเริ่มต้นมีพยากรณ์โรคที่ดีที่สุด แม้ว่าการศึกษานี้จะไม่มีกลุ่มควบคุมของผู้ป่วยที่ไม่ได้รับการผ่าตัด แต่การรอดชีวิต 5 ปีที่ดีกว่ามากหลังการผ่าตัด R0 (36%) เมื่อเทียบกับการผ่าตัดไม่สมบูรณ์ (13%) ชี้ให้เห็นถึงโอกาสความสำเร็จของการผ่าตัดเลาะเนื้องอกที่แพร่กระจาย
ผู้ป่วยเนื้องอกเริ่มต้นที่ได้รับการผ่าตัดเลาะเนื้องอกที่แพร่กระจายซ้ำครั้งแรกมีอัตราการรอดชีวิตเฉลี่ยมากกว่า 60 เดือน; ในกรณีที่มีการผ่าตัดเลาะเนื้องอกที่แพร่กระจายซ้ำครั้งที่สอง อัตราการรอดชีวิตเฉลี่ยอยู่ที่ 34.7 เดือน และในกรณีที่มีการผ่าตัดเลาะเนื้องอกที่แพร่กระจายซ้ำครั้งที่สามหรือมากกว่า อัตราการรอดชีวิตเฉลี่ยอยู่ที่ 45.6 เดือน ผู้ป่วยที่ไม่เหมาะสมสำหรับการผ่าตัดมีอัตราการรอดชีวิตเฉลี่ยอยู่ที่ 8 เดือน
ข้อบ่งชี้ในการผ่าตัดเอาเนื้องอกออก
- เนื้องอกที่เหลือทั้งหมดหลังจากเคมีบำบัดและค่าเลือดตัวบ่งชี้เนื้องอกกลับมาปกติ
- การกลับเป็นซ้ำหลังการรักษาด้วยเคมีบำบัด
- การไม่ตอบสนองต่อการรักษาด้วยเคมีบำบัด
- การตอบสนองบางส่วนต่อเคมีบำบัด
มีการวิเคราะห์ผู้ป่วย 42 รายหลังการผ่าตัดเลาะเนื้องอกที่แพร่กระจายสำหรับเนื้องอกต่าง ๆ และติดตามผลเป็นเวลา 6 ถึง 98 เดือน; อัตราการรอดชีวิต 3 ปีและ 5 ปีอยู่ที่ 45.7% และ 34.6% ตามลำดับ ซึ่งสูงกว่ามากเมื่อเทียบกับอัตราการรอดชีวิตหลังผ่าตัดของมะเร็งปอดชนิด NSCLC ระยะ IIIA (24.9% ถึง 33%) การศึกษาพบว่าการแพร่กระจายของต่อมน้ำเหลืองเป็นปัจจัยพยากรณ์ที่สำคัญ (P < 0.05) โดยมีอัตราการรอดชีวิต 5 ปีที่ 46.9% และ 25.0% ตามลำดับ
References
- Jamil A, Kasi A. Lung Metastasis. 2023 Jan 9. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan–. PMID: 31971751.
- Stella GM, Kolling S, Benvenuti S, Bortolotto C. Lung-Seeking Metastases. Cancers (Basel) 2019 Jul 19;11(7) – PMC –PubMed
- Zhao X, Wen X, Wei W, Chen Y, Zhu J, Wang C. Clinical characteristics and prognoses of patients treated surgically for metastatic lung tumors. Oncotarget. 2017 Jul 11;8(28):46491-46497. – PMC –PubMed
- Caparica R, Mak MP, Rocha CH, Velho PHI, Viana P, Moura MRL, Menezes MR, Amato MBP, Feher O. Pulmonary Nodules in Patients With Nonpulmonary Cancer: Not Always Metastases. J Glob Oncol. 2016 Jun;2(3):138-144. – PMC – PubMed
- Liu C, Li H, Xu K, Song S, He Y, Cai X, Chu X, Yang J, Cui Y. Multiple primary lung cancer versus intrapulmonary metastatic cancer: A case of multiple pulmonary nodules. Thorac Cancer. 2019 Feb;10(2):352-358. – PMC – PubMed
- Dinkel E, Mundinger A, Schopp D, Grosser G, Hauenstein KH. Diagnostic imaging in metastatic lung disease. Lung. 1990;168 Suppl:1129-36. – PubMed
- Herold CJ, Bankier AA, Fleischmann D. Lung metastases. Eur Radiol. 1996;6(5):596-606. – PubMed
- Xiao W, Zheng S, Liu P, Zou Y, Xie X, Yu P, Tang H, Xie X. Risk factors and survival outcomes in patients with breast cancer and lung metastasis: a population-based study. Cancer Med. 2018 Mar;7(3):922-930. – PMC – PubMed
- Gok Durnali A, Paksoy Turkoz F, Ardic Yukruk F, Tokluoglu S, Yazici OK, Demirci A, Bal O, Gundogdu Buyukbas S, Esbah O, Oksuzoglu B, Alkis N. Outcomes of Adolescent and Adult Patients with Lung Metastatic Osteosarcoma and Comparison of Synchronous and Metachronous Lung Metastatic Groups. PLoS One. 2016;11(5):e0152621. – PMC – PubMed
- Tsuchiya A, Imai M, Kamimura H, Togashi T, Watanabe K, Seki K, Ishikawa T, Ohta H, Yoshida T, Kamimura T. Successful treatment of multiple lung metastases of hepatocellular carcinoma by combined chemotherapy with docetaxel, cisplatin and tegafur/uracil. World J Gastroenterol. 2009 Apr 14;15(14):1779-81. – PMC –PubMed
- Nakamura T, Matsumine A, Yamada S, Tsukushi S, Kawanami K, Ohno T, Katagiri H, Sugiura H, Yamada K, Yamada Y, Sudo A, Nishida Y. Oncological outcome after lung metastasis in patients presenting with localized chondrosarcoma at extremities: Tokai Musculoskeletal Oncology Consortium study. Onco Targets Ther. 2016;9:4747-51. – PMC – PubMed
- Qi H, Fan W. Value of ablation therapy in the treatment of lung metastases. Thorac Cancer. 2018 Feb;9(2):199-207. – PMC –PubMed
- Kerr VE, Cadman E. Pulmonary metastases in ovarian cancer. Analysis of 357 patients. Cancer. 1985 Sep 01;56(5):1209-13. –PubMed
- Younes RN, Gross JL, Taira AM, Martins AA, Neves GS. Surgical resection of lung metastases: results from 529 patients. Clinics (Sao Paulo) 2009;64(6):535-41. –PMC – PubMed